
聚前沿文献之声,解泌尿学术之惑

聚前沿文献之声,解泌尿学术之惑,这里是聚焦前列腺癌的《菲长视野 · 前献解泌》专栏。
本期与我们用声音见面的是北京协和医院周智恩教授,他将与大家一同分享一项近期发表于《European Urology》杂志(影响因子:25.2)的有关T细胞接合剂(T-cell engagers,TCEs)在转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)领域研究进展的综述。
研究背景
前列腺癌(prostate cancer,PC)是一种常见的恶性肿瘤,其治疗面临诸多挑战。传统的免疫治疗药物在晚期PC患者中效果有限,主要原因之一是PC的肿瘤免疫微环境属于“冷”型,即免疫细胞难以浸润和发挥作用。在这种背景下,TCEs作为一种新型的免疫治疗方法应运而生。TCEs通过同时结合T细胞受体(T-cell receptor,TCR)上的CD3分子和癌细胞上的特定肿瘤相关抗原,诱导T细胞介导的癌细胞杀伤,从而绕过了正常T细胞激活所需的复杂步骤,为PC的治疗带来了新的希望[1]。
研究结果
● 双特异性TCEs在mCRPC中的应用
本文针对接受过紫杉烷类和雄激素受体通路抑制剂(androgen receptor pathway Inhibitors,ARPI)治疗的mCRPC患者,汇总了多项双特异性TCE(Bispecific T-cell engagers,BiTEs)治疗的研究进展(表1)。
表1 T细胞结合剂治疗转移性去势抵抗性前列腺癌患者的研究
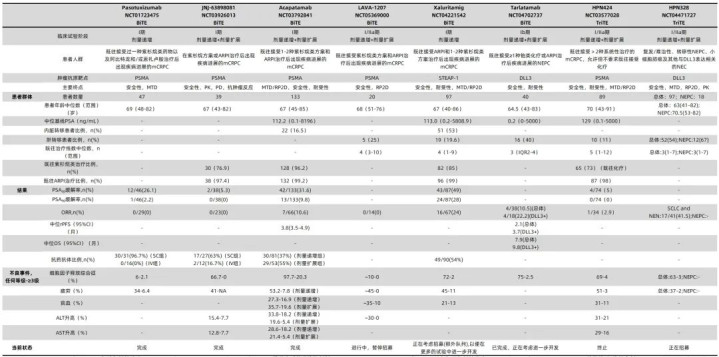

前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)在前列腺癌细胞上的表达量远高于正常细胞,为针对PSMA的BiTEs开发提供了依据。在Pasotuxizumab(AMG 212)和JNJ-63898081的试验中患者前列腺特异性抗原(prostate-specific antigen,PSA)减少50%的比例(PSA50缓解率)分别为26.1%和5.3%,但这些缓解持续时间较短,且频繁出现的抗药物抗体限制了药物的血清暴露,最终导致这些药物的早期停用。
另外,Acapatamab(AMG 160)也是一种针对PSMA的BiTE,因其半衰期更长,因此给药间隔更久,从而避免了持续输注。在一项开放标签、多中心的研究中,Acapatamab治疗后PSA50缓解率可达31.6%。在66例实体肿瘤反应评估标准(Response Evaluation Criteria In Solid Tumours,RECIST)可评估的患者中,10.6%达到了部分缓解(partial response,PR),37.9%达疾病稳定(stable disease,SD)。在安全性方面,细胞因子释放综合征(cytokine release syndrome,CRS)是最常见的不良事件(97.7%),其中20.3%的患者发生了3级CRS。此外,40.6%的患者出现了眼部疾病(例如视力模糊和视觉障碍)。与其它TCEs相比,Acapatamab的高不良事件发生率可能与药物的半衰期有关。尽管有初步的临床活性,但由于毒性问题(CRS)和缺乏持久的抗肿瘤反应,Acapatamab不再进行进一步的临床开发。
Xaluritamig(AMG 509)是一种针对前列腺六段跨膜上皮抗原1(six-transmembrane epithelial antigen of the prostate 1,STEAP-1)的BiTE,STEAP-1是一种在前列腺癌细胞上高表达的细胞表面抗原,在正常组织上的表达有限。STEAP-1与癌细胞的增殖和侵袭相关,并且在对治疗产生耐药性的mCRPC组织中广泛表达。在大量经治的患者中,Xaluritamig显示出抗肿瘤活性,PSA50缓解率高达49%,PSA90缓解率可达28%,并且在所有剂量队列中都可观察到类似结果。在67例RECIST可评估的患者中,16例(24%)达到了PR,32例(48%)达到SD。在安全性方面,72%的患者发生了CRS,但只有2%的患者发生了3级CRS。基于这些令人鼓舞的缓解率和安全性特征,目前正计划进行Xaluritamig的III期注册试验。
Tarlatamab(AMG 757)作为靶向δ样配体3(delta-like ligand 3,DLL3)的BiTE,在美国获批小细胞肺癌适应证后,也在进行用于新发或治疗相关的神经内分泌前列腺癌(neuroendocrine prostate cancer,NEPC)患者的研究。根据RECIST v1.1评估结果,患者客观缓解率(objective response rate,ORR)达10.5%。最常见的治疗相关不良事件是CRS(75%),只有一例患者发生了3级CRS(2.5%)。
● 三特异性TCEs
三特异性T细胞接合剂(trispecific T-cell engager,TriTEs)具有第三个结合域,可用于肿瘤相关抗原的双重靶向、TCRs的双重靶向或与人血清白蛋白(human serum albumin,HAS)结合以延长半衰期。HPN424和HPN328是结合HSA的TriTEs,既往分别在mCRPC和治疗相关的NEPC中进行评估,在早期研究中显示出抗肿瘤活性和可接受的安全性特征。
● 患者选择与未来方向
基于现有数据发现,TCEs是mCRPC患者的新型治疗选择。然而,这些药物面临着包括疗效有限和CRS发生率高等挑战。为了克服这些挑战,未来的研究方向可能包括:
1.联合治疗方案
TCEs与具有非重叠抗肿瘤作用机制的药物的联合方案有可能在不增强不良反应的情况下提高TCEs的疗效。例如,一项II期研究评估了在mCRPC患者中,帕博利珠单抗与HER2双特异性抗体武装活化的T细胞(HER2-bispecifc antibody-armed activated T cells,HER2 BAT)联合方案。结果显示:在14例受试者中,5例(38.5%)达到了6个月无进展生存的主要终点,且该方案相对耐受性良好,值得进一步研究。
此外,目前正在进行的多项试验也正在评估TCEs与不同类别抗肿瘤药物(包括ARPI、程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)抑制剂、白细胞介素-2或B7-H3靶向抗体-药物偶联物)的联合方案。
2. 早期治疗
在疾病早期给予TCEs有可能提高其疗效,因为患者在早期状态更好,免疫系统更健全且耐受性更低,疾病负担也更小。然而,在评估其早期治疗的应用之前,需要现有研究成熟的疗效和安全性数据作为依据。
3. 基于生物标志物的患者选择
基于生物标志物选择患者是提高TCEs疗效的另一途径。例如,在一项探索性生物标志物分析中,基线时PSMA在PSMA正电子发射-计算机断层扫描(positron emission tomography computed tomography,PET-CT)上的高表达与Acapatamab的疗效改善相关。在另一项探索性分析中,在DLL3阳性的患者中,Tarlatamab的ORR为22.2%(总体队列中为10.5%),中位总生存期为9.8个月(总体队列中为7.9个月)。
研究结论
TCEs作为一种新型的前列腺癌治疗选择,具有一定的潜力,但目前的疗效有限。未来的临床试验结果将有助于确定TCEs的最佳使用方式,包括联合治疗方案、早期治疗以及基于生物标志物的患者选择。通过这些策略的探索和优化,有望进一步提高TCEs在前列腺癌治疗中的疗效和安全性,为患者带来更多的治疗选择和希望。
专家有话说
尽管TCEs具有机制独特、疗效可观等优点,目前其临床开发仍面临一些挑战。目前,限制TCEs应用的主要挑战是免疫相关毒性,从本综述汇总的数据可以看到,TCEs的CRS发生率高达70%~96%,可能会导致患者出现≥3级的严重不良事件,甚至需要住院或者进入神经重症监护病房(Neurological Intensive Care Unit,NICU)处理。此外,多种TCEs在皮下注射或持续输注的给药模式下可以诱导出抗药抗体,显著影响了药物的暴露和持续性,这将缩短患者PSA50缓解时间,影响患者长期获益。因此,如果TCEs的疗效持续时间和药物安全性问题不能得到有效解决,那么势必将限制其远期应用。
总体而言,本综述为我们带来三项启发:第一,强调了早期干预的重要性。免疫细胞未耗竭的患者可能从早期免疫治疗中获益。因此,明确免疫治疗的黄金干预窗口,是免疫治疗在前列腺癌中应用的重点和难点。掌握这个关键特征,将有望为患者带来更好的疾病控制。第二,强调生物标志物和影像学在患者筛选中的应用价值。众所周知,PSMA表达水平影响患者治疗应答。因此,我们应当推动PSMA PET-CT的应用,从而能更好地筛选出治疗优势人群。第三,强调系统性联合治疗策略。单一TCEs治疗也可能产生耐药,通过多种治疗手段联合有望延长患者生存期。
因此,中国转移性前列腺癌治疗模式可能需要改变,从以往的姑息治疗变成主动治疗。另外,前列腺癌要加强推动多学科诊疗模式(multi⁃disciplinary treatment,MDT)。MDT模式使患者不必局限于泌尿外科或肿瘤内科的单一治疗模式。通过多科室协作,可以为患者带来更好的治疗获益。此外,结合新药的研究趋势,我们也应提前布局免疫治疗探索,从而为mCRPC患者带来更好的替代治疗方案。
此外,ADT是转移性前列腺癌患者的基础治疗方法,促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist,GnRH-a)是常用ADT药物之一。2023年6月曲普瑞林6月剂型在中国获批,为我国前列腺癌患者带来了更为丰富、灵活的剂型选择。研究表明,曲普瑞林可以持续降低血清PSA水平并维持深度降酮。一项回顾性汇总分析,纳入3项前瞻性III期研究中共计592例前列腺癌患者(大多数接受曲普瑞林单药治疗,仅4例接受雄激素受体轴靶向治疗)的数据,旨在评估患者接受曲普瑞林治疗后达到的睾酮最低值是否与总生存期(overall survival,OS)和疾病特异性生存期(disease-specific survival,DSS)改善有关[2]。结果显示,在意向治疗(intention-to-treat,ITT)人群中,经曲普瑞林治疗后睾酮水平<10、≥10且<20、≥20且<50和≥50 ng/dL的患者比例分别为96%、3.2%、0.34%和0.17%。主分析结果显示,随着睾酮最低值的降低,患者的OS更好(所有p均<0.001),在敏感性/补充性分析中仍可观察到这一趋势。主分析未观察到睾酮最低值降低与DSS的改善显著相关,敏感性/补充性分析结果显示,随着睾酮最低值的降低,患者的DSS更高(1-262天,p=0.01;合并组1-518天,p=0.03;合并组1-262天,p=0.005)。
同时,曲普瑞林6月剂型对初治和经治患者均可有效降低PSA。一项真实世界、回顾性的、非干预研究[3],纳入了88例接受6月剂型曲普瑞林治疗的转移性前列腺癌患者,其中47例初始接受曲普瑞林6月剂型治疗,41例由GnRH-a 1月/3月剂型更换为曲普瑞林6月剂型治疗。在治疗12个月时,初始6月剂型曲普瑞林治疗患者中位PSA从诊断时的23.50 ng/mL下降为1.30 ng/mL,更换为6月剂型曲普瑞林治疗患者中位PSA从换药时的0.35 ng/mL下降为0.24 ng/mL[3],揭示了曲普瑞林6月剂型无论对初治亦或是经治患者均可有效降低PSA,疗效稳定。
转移性前列腺癌的长期治疗目标是稳定疾病。曲普瑞林6月剂型一年仅需两次注射便可为患者持久维持睾酮去势水平,持续降低血清PSA水平,显示出长效的疾病控制能力,治疗模式高度便捷,助力我国构建更高效、更人性化的前列腺癌全程管理模式,前景可期。
专家简介

周智恩 教授
北京协和医院
北京协和医院,副主任医师,副教授,博士
北京医师协会泌尿外科专科医师分会常务理事兼总干事
北京医学会泌尿外科学分会青年委员
中国抗癌协会泌尿男生殖系肿瘤专委会人工智能与机器人学组委员
中国研究型医院学会肿瘤学专业委员会委员
中国性学会前列腺分会委员
中国老年保健协会泌尿外科与男科学专委会委员
北京性腺轴疾病防治研究会理事
北京市泌尿外科专业质控和改进中心专委会委员
北京市科协人才举荐评审专家
主要研究方向为泌尿系肿瘤及微创泌尿外科
参考文献
1.Hage Chehade C, et al. Eur Urol. 2025 May;87(5)553-558.
2.Klotz L, et al. BJUI Compass. 2024 Jan 10;5(3):392-402.
3.Cornford P, et al. Oncol Ther. 2018, 6(2) 173-87.
审校:Nobody
执行:Lya
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
DIP_PC-CN-000353
DIP_PC-CN-000354
